膠原蛋白是我們身體中含量最豐富的蛋白質,約占人體總蛋白含量的 30%,皮膚干重的 75% 以及肌腱組成的 85%。膠原蛋白在維持組織結構的完整性和穩定性、以及促進組織再生等方面發揮著重要作用,更是被譽為肌膚保持年輕的“軟黃金”!除了醫美市場,以“軟黃金”為主要成分的生物醫用材料,也在皮膚醫學、心血管外科、眼科和組織工程等領域中廣泛應用。例如,膠原蛋白膜被用于燒傷和外傷的治療護理;膠原蛋白海綿在臨床上具有很好的止血作用,能使創口滲血很快凝固;膠原蛋白還可作為藥物載體治療各種眼病,促進眼角膜傷口的愈合。作為合成生物學的趨勢成分,“軟黃金”已從實驗室走向市場,膠原蛋白“重”生,賽道如火如荼!根據 Grand View Research 的數據,全球膠原蛋白市場規模在 2022 年達到 172.58 億美元,預計 2027 年將達到 226.22 億美元,年復合增長率為 5.42%。中國膠原蛋白市場 2016—2027 年年均復合增長率預計為 6.54%,2027 年預計增長到 15.76 億美元。據統計,2022 年我國重組膠原蛋白市場規模為 185 億元,占膠原蛋白市場規模的 46.6%;預計到 2027 年達到 1083 億元,占膠原蛋白市場規模的 62.3%。國內市場中膠原蛋白代表性公司有巨子生物、錦波生物、華熙生物、丸美生物、暨源生物、創健醫療、江山聚源生物等。國外代表性公司有 FibroGen,Gelter,NIPPI,Integral Life Sciences,Collagen Solution 等。
“軟黃金”如何從實驗室走向市場的?
在農業領域,通過改造代謝途徑、遺傳回路或者生物體結構,研究人員可以提高農作物的產量。同時,可持續農業是合成生物學應用的另一方向,例如通過改造微生物來進行生物施肥或者生物控制等。
公元前 3000 年 - 19 世紀 膠原蛋白的發現與使用
在古埃及和古希臘時期,人們利用獸皮和獸骨等富含膠原蛋白的材料來達到醫療和美容的目的。西漢時期,我國現存最早的醫方著作《五十二病方》中也有記載“以皮制膠,涂之以創,愈之”。
19 世紀 膠原蛋白分子水平的認識
人們對膠原蛋白分子水平的認識始于 19 世紀。1844 年,法國化學家蒙特古(Maurice Raynaud)首次將膠原蛋白命名為 "Collagen"。
20 世紀初-中期 膠原蛋白結構與功能的研究
20 世紀初,科學家喬爾·萊布(Jo?l Le Magnen)提出了膠原蛋白的三股螺旋結構假設,為后來的研究奠定了基礎。20 世紀中期,哈佛大學發現膠原蛋白溶液加熱到人體正常體溫時轉變為凝膠。隨著合成生物技術的發展,科學家們進一步研究不同類型的膠原蛋白在組織中的分布和功能。
20 世紀末至今 膠原蛋白市場化應用
膠原蛋白研究的突破始于 20 世紀 80 年代,1981 年,歷史上第一款動物膠原蛋白產品——牛源膠原蛋白產品 Zyderm 正式被 FDA 獲批,在歐美掀起一陣注射膠原蛋白美容的風潮。但由于動物源存在疾病感染風險,研究人員將焦點聚集到利用基因工程生產重組膠原蛋白的方向上。1997 年,Vuorela 等人成功利用畢赤酵母表達了人Ⅰ,Ⅱ,Ⅲ型膠原蛋白全序列。2002 年,西北大學范代娣等人采用PCR技術獲得人膠原蛋白基因片段,通過高密度發酵方式培養生產類人膠原蛋白。2009 年,Werten 等利用基因工程制備了具有生物活性的人源性明膠,經純化后替代動物來源的膠原蛋白用作疫苗穩定劑。2010 年,范代娣課題組成功利用大腸桿菌基因工程菌 BL21(DE) 發酵生產并分離純化了類人膠原蛋白,改進了動物體膠原蛋白的水溶性、免疫排異性、吸收性等特性,并通過和西安巨子生物合作進行規模化生產。目前,以膠原蛋白為基礎的產品在醫美和保健行業比較流行,包括抗衰護膚、傷口愈合、美容手術等。
基因工程重組膠原蛋白
基因工程重組膠原蛋白是將人體膠原蛋白基因進行特定序列設計、酶切和拼接、連接載體后轉入宿主細胞內,包括微生物、動物和植物等,再進行發酵誘導表達生產的膠原蛋白或類似物的技術。重組膠原蛋白的生產過程主要包括表達體系的構建、發酵和純化。由于動、植物細胞的培養難度大,成本高,不適合大規模生產,采用大腸桿菌、酵母等微生物作為宿主是較為理想的選擇,也逐漸成為重組膠原蛋白工業化的趨勢。
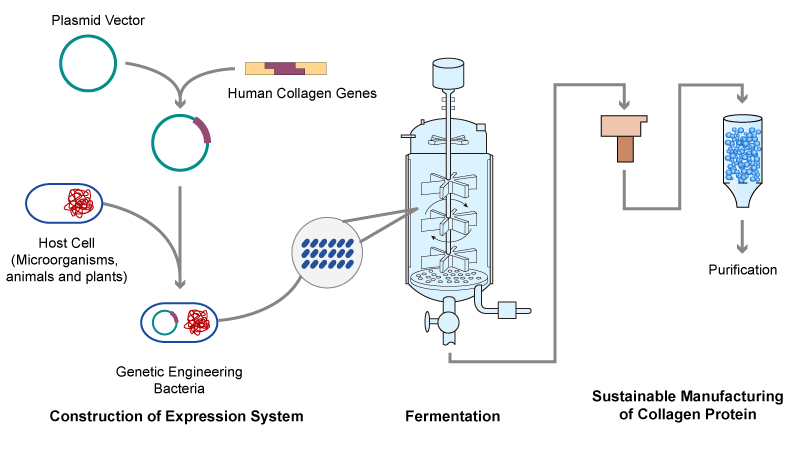
重組膠原蛋白綠色制造
在 2021 年 3 月 15 日國家藥監局發布的《重組膠原蛋白生物材料命名指導原則》中,將重組膠原蛋白主要分為三類:重組人膠原蛋白、重組人源化膠原蛋白以及重組類膠原蛋白。
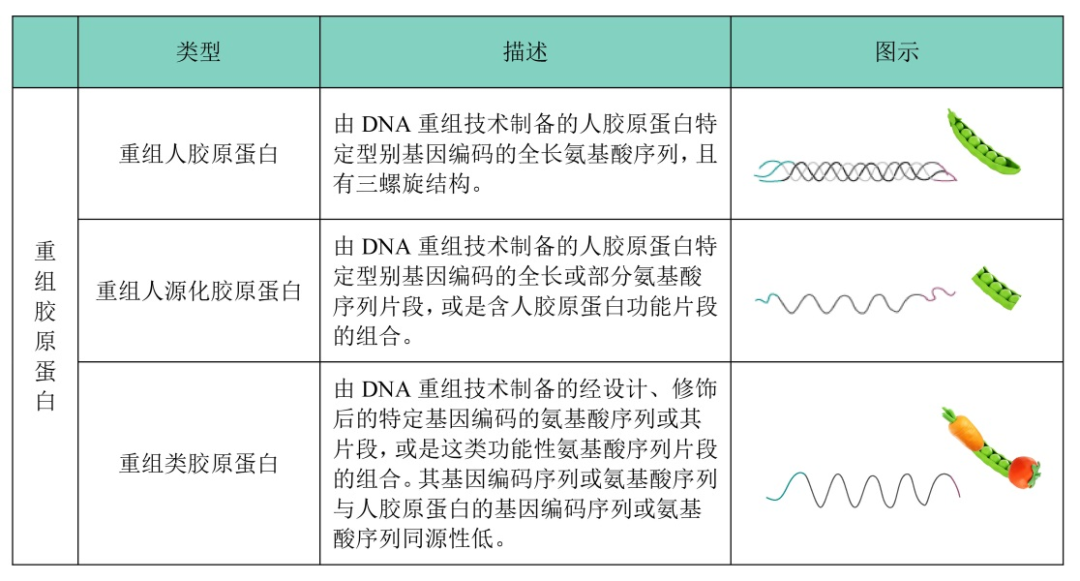
基因工程重組膠原蛋白技術難點
膠原蛋白以膠原纖維的形式存在。其基本結構單位是原膠原分子,長度約 300nm,分子量約為 300kDa。每個原膠原都有一種特殊的三重螺旋結構,由 3 條 α- 螺旋的肽鏈纏繞而成;三螺旋區段最大特征是氨基酸呈 (Gly-X-Y)n 周期性排列,每條 α 鏈大約含有 300 個左右 (Gly-X-Y) 的重復結構。X、Y 位置可以是任何氨基酸,多為脯氨酸和羥脯氨酸。在三螺旋構象穩定過程中羥脯氨酸羥基能形成強氫鍵,可提高膠原蛋白強度;脯氨酸和羥脯氨酸能使膠原三螺旋結構發生急劇扭曲,提高膠原蛋白的穩定性。研究發現,亞氨基酸(脯氨酸和羥脯氨酸)的含量越高,膠原蛋白三螺旋結構相對越穩定。
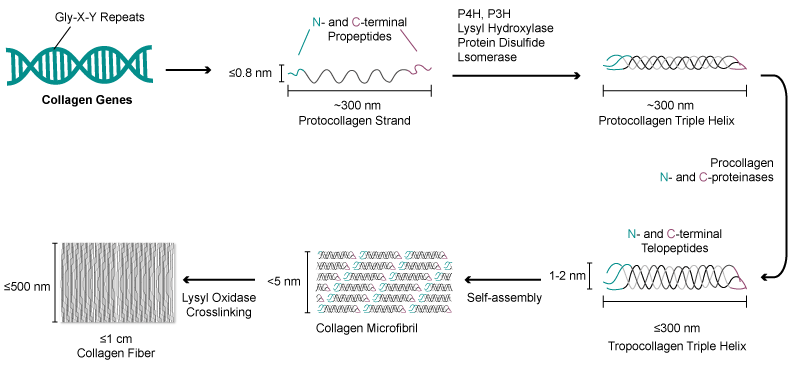
膠原蛋白纖維結構
三螺旋膠原蛋白分子組裝成超分子結構的能力是膠原蛋白在醫療應用(如美容手術和組織修復)中商業用途的基礎。破壞膠原蛋白三重螺旋的穩定性會阻礙其自組裝,或削弱富含膠原蛋白的結構,這表明正確的氨基酸序列對膠原蛋白的正常功能至關重要。因此,在制備具有特定膠原蛋白序列的三螺旋多肽時,主要的技術難點在于基因片段的選擇及三螺旋結構的穩定性。于此同時,在細胞發酵、蛋白純化等環節,工業化制備的重組膠原蛋白的產量、及純度仍有很大的提升空間。
重組膠原蛋白產量優化從基因源頭開始
泓迅科技擁有先進的合成生物賦能技術平臺。自主研發 Complex Index(CI)、NGCodon
TM、AI-TAT、DNA Studio
TM 等多款生物智能分析工具,與自有專利試劑 Syno Interlinkage 、Syno Assembly 相結合,推動基因合成向著更加智能化、精準化和快速化方向發展。我們在重組膠原蛋白基因合成上擁有豐富經驗,超前設計、先進制造與核心工具相結合,精準合成重組膠原蛋白“高”重復基因。定制化基因合成設計方案、優質的大腸桿菌工程菌株庫與完整的分子克隆工具酶體系,幫您解決源頭基因合成難點!協助您在實驗室中以極低的成本嘗試大量的基因設計,提高膠原蛋白的表達量、親水性和可加工性,創造更多應用可能。
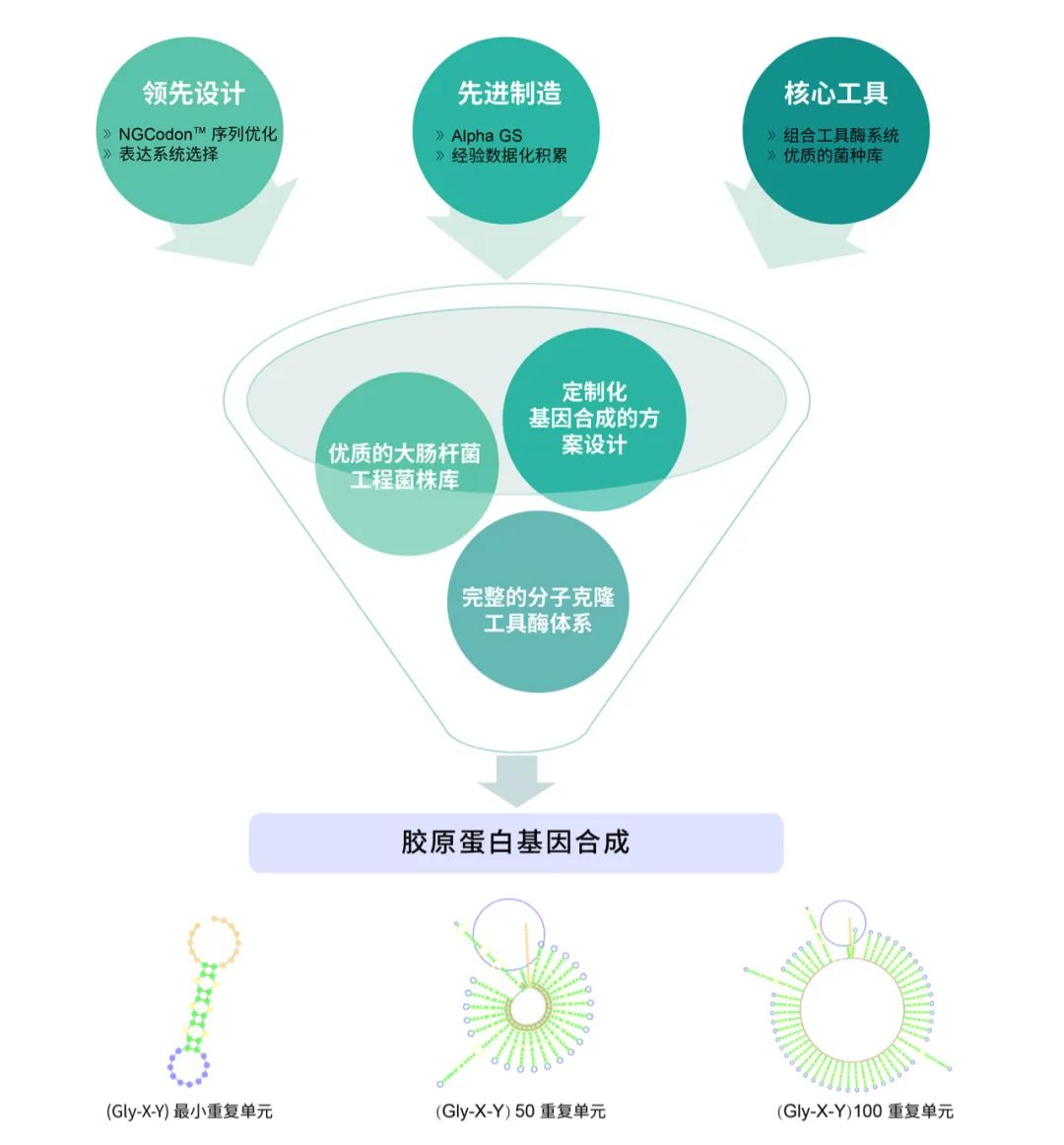
定制化膠原蛋白基因合成方案
未/來/展/望
重組膠原蛋白正在經歷著從 “日常護膚” ,到“醫療美容”,到“醫療器械”,再到“生命科學”應用的路徑演變。實現膠原蛋白的定量表達、功能定向強化以及規模化生產優化不是一蹴而就的事情。人工智能也在推動生物研究的前沿發展,幫助科學家對膠原蛋白進行“編程”,就像軟件工程師編寫“代碼”一樣!未來,以“基因調控,工程設計”為核心,從膠原蛋白分子的定向設計、細胞工廠構建與適配調控等方面出發,并通過設計、構建和測試優化逐步突破自然進化的限制。在人工設計指導下,實現膠原蛋白從 “日常護膚” 到 “生命科學”的跨越值得期待!
Reference:[1] 何會霞. 重組膠原蛋白及其生物材料的制備和性質研究[D].蘭州大學,2023.DOI:10.27204/d.cnki.glzhu.2023.000164.[2] 魏春,劉春,劉心雨等.基因工程技術生產重組膠原蛋白的 研究進展[J].發酵科技通訊,2021,50(01):1-5.DOI:10.16774/j.cnki.issn.1674-2214.2021.01.001.[3] 李陽,朱晨輝,范代娣.重組膠原蛋白的綠色生物制造及其應用[J].化工進展,2021,40(03):1262-1275.DOI:10.16085/j.issn.1000-6613.2020-2109.[4] Fertala A. Three Decades of Research on Recombinant Collagens: Reinventing the Wheel or Developing New Biomedical Products? Bioengineering (Basel). 2020 Dec 2;7(4):155. doi: 10.3390/bioengineering7040155.[5] Sorushanova A, Delgado LM, Wu Z, Shologu N, Kshirsagar A, Raghunath R, Mullen AM, Bayon Y, Pandit A, Raghunath M, Zeugolis DI. The Collagen Suprafamily: From Biosynthesis to Advanced Biomaterial Development. Adv Mater. 2019 Jan;31(1):e1801651. doi: 10.1002/adma.201801651.[6] Koide T. Designed triple-helical peptides as tools for collagen biochemistry and matrix engineering. Philos Trans R Soc Lond B Biol Sci. 2007 Aug 29;362(1484):1281-91. doi: 10.1098/rstb.2007.2115.[7] 范代娣,段明瑞,米鈺等.重組E.coli工程菌高密度培養生產人源型膠原蛋白[J].化工學報,2002(07):752-754.本文地址:
http://www.dayishuiji.com/jiankang/50746.html - 轉載請保留原文鏈接。
| 免責聲明:本文轉載上述內容出于傳遞更多信息之目的,不代表本網的觀點和立場,故本網對其真實性不負責,也不構成任何其他建議;本網站圖片,文字之類版權申明,因為網站可以由注冊用戶自行上傳圖片或文字,本網站無法鑒別所上傳圖片或文字的知識版權,如果侵犯,請及時通知我們,本網站將在第一時間及時刪除。 |
 重組膠原蛋白綠色制造
重組膠原蛋白綠色制造
 膠原蛋白纖維結構
膠原蛋白纖維結構 定制化膠原蛋白基因合成方案
定制化膠原蛋白基因合成方案