
合成生物學(xué)結(jié)合了分子生物學(xué)、系統(tǒng)生物學(xué)和生物工程以全新的方式重新設(shè)計生物系統(tǒng),讓研究人員能夠任意研究、改變、復(fù)制、甚至改造出復(fù)雜的生物路徑、DNA基因序列與生物系統(tǒng),進而為醫(yī)學(xué)、制造業(yè)及農(nóng)業(yè)等領(lǐng)域提供高效的解決方案。合成生物學(xué)一直是創(chuàng)新的引擎,不斷推動我們對生物系統(tǒng)的重新構(gòu)想。
泓迅科技自成立以來,一直致力于成為合成生物學(xué)領(lǐng)域的領(lǐng)軍公司。我們依托完備的基因制造平臺和生物設(shè)計平臺,閉環(huán)滿足DBTL技術(shù)需求,為合成生物學(xué)的發(fā)展和創(chuàng)新提供了強大的技術(shù)工具和解決方案。我們始終秉持科技創(chuàng)新的理念,持續(xù)提升服務(wù)能力和質(zhì)量,透過深入的研究和前瞻性的專利,譜寫這場生命的合成交響曲。
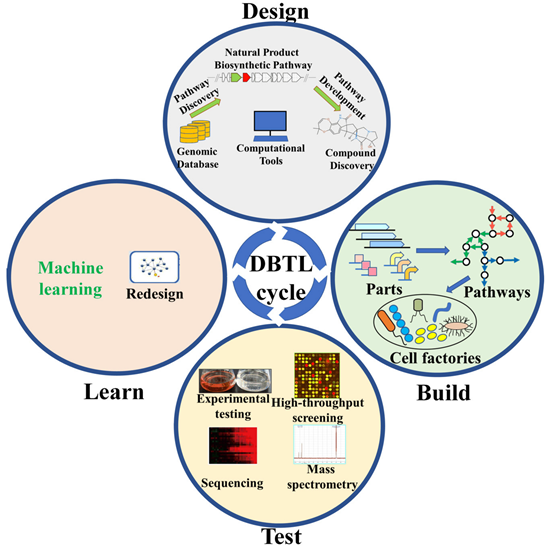
合成生物學(xué)從底層脫氧核苷酸出發(fā),經(jīng)DNA小片段到DNA大片段乃至到整個基因組,從單一零散的元器件到功能模塊再到整個生命系統(tǒng)網(wǎng)絡(luò),“自下而上”地逐級構(gòu)筑生命活動,通過合成生物學(xué)的核心策略“設(shè)計?構(gòu)建?測試?學(xué)習(xí)”(DBTL)來創(chuàng)造新功能生命體,實現(xiàn)從非生命物質(zhì)到生命體系的跨越。
泓迅科技建立了先進的合成生物學(xué)賦能技術(shù)平臺,提供完整的“設(shè)計—構(gòu)建—測試—學(xué)習(xí)”各個環(huán)節(jié)一體化生物系統(tǒng)解決方案,為合成生物學(xué)應(yīng)用領(lǐng)域的合作伙伴們提供序列設(shè)計、基因合成、基因編輯、文庫構(gòu)建、抗體工程、定向進化、蛋白表達、基因檢測等多元化服務(wù),滿足不同階段的研究需求。
泓迅科技DBTL的循環(huán)迭代過程:
設(shè)計(Design)階段,借助計算機輔助設(shè)計,精心構(gòu)建合成基因和生物回路。通過系統(tǒng)性的計劃和模擬,能夠在虛擬環(huán)境中預(yù)測生物系統(tǒng)的行為,為后續(xù)實驗提供有力指導(dǎo)。
構(gòu)建(Build)階段,合成基因被引入生物體,開啟合成生物學(xué)構(gòu)建的關(guān)鍵步驟。這包括DNA的合成、大片段的組裝以及基因編輯等技術(shù)手段。在這個階段,理論的構(gòu)想被具體地體現(xiàn)在生物體內(nèi),為測試和評估奠定基礎(chǔ)。
測試(Test)階段著眼于生物系統(tǒng)的性能評估。通過精密的實驗和測量,能夠獲取生物體的實際行為數(shù)據(jù)。
最后,學(xué)習(xí)(Learn)階段,根據(jù)測試結(jié)果進行深入分析,并結(jié)合學(xué)到的經(jīng)驗知識優(yōu)化設(shè)計。通過迅速學(xué)習(xí)和調(diào)整,能夠快速優(yōu)化生物系統(tǒng),不斷改進設(shè)計方案,推動著合成生物學(xué)和生物制造的不斷創(chuàng)新。
(Metabolites. 2021;11(11):785)
合成生物學(xué)構(gòu)建了一個連接科學(xué)和創(chuàng)意的橋梁,打破了我們對生物學(xué)的傳統(tǒng)認知。從微生物的工程到基因組合成,我們正在描繪一幅全新的DNA圖譜,每一次合成都是對未知領(lǐng)域的探險,是對生命奧秘的深刻思考。我們驕傲地宣布,研究團隊在合成生物學(xué)構(gòu)建領(lǐng)域取得了里程碑式的突破,并成功獲得了多項重要的專利,這些專利不僅僅代表了我們對科學(xué)的貢獻,更是對合成生物學(xué)構(gòu)建理念的印證。
本發(fā)明提供一種重復(fù)性DNA的合成與組裝方法,該方法包括重復(fù)性DNA序列分析;序列拆分與接口選擇;引物的設(shè)計;DNA片段的合成;重復(fù)性DNA的組裝。
專利亮點:
性能更加完善:增加了組裝反應(yīng)可靠性與穩(wěn)定性,確保合成過程更為順暢。
適用范圍擴大:該方法可制備重復(fù)性DNA的PCR產(chǎn)物文庫和重復(fù)性DNA的PCR產(chǎn)物,擴展了組裝產(chǎn)物的適用范圍。
本發(fā)明通過CRISPR/Cas9方法對釀酒酵母基因組進行改造,獲得了三種大片段DNA高效組裝基因工程酵母菌Synbio?Sc1、Synbio?Sc2和Synbio?Sc3。
專利亮點:
可組裝大片段DNA:基因工程酵母菌展現(xiàn)了卓越的能力,能夠組裝高達60kb的大片段DNA,為大片段DNA的組裝提供了可行的解決方案。
高效率組裝:組裝效率高達63.5%至93.8%,這一技術(shù)突破有望在合成生物學(xué)與基因合成的工業(yè)研究與生產(chǎn)中發(fā)揮關(guān)鍵作用。
降低生產(chǎn)成本:本發(fā)明的基因工程酵母菌還具有降低生產(chǎn)成本的潛力,這為基因合成與合成生物學(xué)DNA構(gòu)建的工業(yè)研究與生產(chǎn)帶來了重要意義,為實現(xiàn)更經(jīng)濟高效的生物制造奠定了基礎(chǔ)。
本發(fā)明提供一種酵母細胞同源重組酶系與原核細胞表達重組酶的DNA體外組裝試劑。
專利亮點:
全新構(gòu)建方式:創(chuàng)新性地采用了DNA合成構(gòu)建方式,首次提供了一種利用酵母細胞同源重組酶系以及部分原核細胞表達重組酶制備的DNA體外組裝試劑。
高效快速組裝:利用DNA體外組裝試劑,可以對兩端帶有同源臂的DNA片段進行快速體外組裝,實現(xiàn)單鏈與雙鏈DNA的快速構(gòu)建。該方法在僅1小時內(nèi)單次可以完成4~40條單鏈引物或2~6個雙鏈片段的無縫組裝。
本發(fā)明提供了一種基因突變文庫的合成方法及其應(yīng)用,所述方法包括:通過PCR反應(yīng)將雙鏈DNA轉(zhuǎn)換成含有dUTP的單鏈DNA,通過梯度降溫式退火反應(yīng)將Trimer引物連接至上述含有dUTP的單鏈DNA上,退火后經(jīng)過序列延伸、連接反應(yīng),形成Trimer結(jié)合下的雙鏈雜合DNA突變序列集合,將所述集合經(jīng)UDG酶消化后,進行PCR擴增,將擴增產(chǎn)物與載體重組連接形成重組質(zhì)粒,即可得到基因突變文庫。
專利亮點:
操作簡單、綜合成本低的PCR技術(shù)以及結(jié)合其它分子生物學(xué)技術(shù),能夠快速實現(xiàn)高正確率、高多樣化的基因突變文庫合成,尤其適用于一個在基因中的多個區(qū)域同時進行多樣化文庫構(gòu)建。
提高了一個基因上多個可變區(qū)域同時多樣化的效率,大大增加了突變序列的正確率,對抗體工程、酶工程、合成生物學(xué)等領(lǐng)域關(guān)鍵基因的挖掘與優(yōu)化具有重要意義。
目的:合成組裝14Kb的復(fù)雜基因片段,并將目的基因組裝到pSynoYac0-Cm (約10Kb) 載體上。

難度分析:
目的片段中GC含量波動較大,局部區(qū)域甚至高達100%。
目的片段中有多個重復(fù)片段,直接重復(fù)649bp片段4個,1579bp片段2個,反向重復(fù)649bp片段4個,1299bp片段2個。

目的片段的GC含量分析圖

目的片段的重復(fù)序列分析圖
方法:
通過調(diào)整PCR反應(yīng)體系中聚合酶、離子及其它組分含量,并優(yōu)化退火溫度、延伸時間等PCR擴增程序的參數(shù),來保證PCR鏈式組裝的成功率和保真性。
目的片段中有較多個超過500bp的重復(fù)序列,常規(guī)的組裝方案很容易發(fā)生錯配。針對這一難點,我們從開始就進行針對性設(shè)計及優(yōu)化,靈活聯(lián)用酶切連接、Golden Gate及Gibson組裝等方法分段組裝合成重復(fù)序列的中間構(gòu)建。
結(jié)果:交付給客戶的最終構(gòu)建與客戶需求的目的序列100%匹配。
目的:合成組裝堿基長度為37848bp的目標片段,并將合成的片段組裝至pSynoYac1-Cm (約10kb)上。

難度分析:
合成該目的片段需要400多條小片段寡核苷酸,進行80多次的重疊延伸PCR拼接組裝,工作量較大,成功率較低。
序列的復(fù)雜度較高,GC含量波動大,長重復(fù)序列(≥20bp)多達108個。
38kb片段與10kb載體的組裝難度大,成功率低。

目的片段的GC含量分析圖

目的片段的重復(fù)序列分析圖
方法:
用CRISPR基因編輯技術(shù)對釀酒酵母BY4741基因組進行了改造,開發(fā)得到一株酵母菌,顯著提高了酵母體內(nèi)同源重組的特異性、成功率以及組裝穩(wěn)定性。
針對片段缺失,改良酵母轉(zhuǎn)化的操作流程和反應(yīng)體系配方,顯著增加了釀酒酵母大片段DNA的轉(zhuǎn)化效率。
結(jié)果:通過上述一系列的優(yōu)化改進,最終成功獲得100%正確目的序列。
目的:對全合成人源化抗體序列的6個CDR序列區(qū)同時進行基因多樣性變化設(shè)計,構(gòu)建一種全合成人源化抗體基因突變文庫。
難度分析:
目前市面上實現(xiàn)6個CDR序列區(qū)的每個氨基酸位點同時進行多樣性變化的文庫構(gòu)建方法效率很低。
隨著CDR區(qū)數(shù)目增多,每個CDR區(qū)的正確率無法保證。
方法:
通過PCR反應(yīng)將全合成人源化抗體原DNA序列轉(zhuǎn)換成含有dUTP的單鏈DNA;
通過梯度降溫式退火反應(yīng)將6個CDR區(qū)的Trimer引物同時連接至上述含有dUTP的單鏈DNA上;
步驟2退火后的序列經(jīng)過延伸、連接反應(yīng),形成Trimer結(jié)合下的雙鏈雜合DNA突變序列集合;
將上述集合經(jīng)UDG酶消化,以消化產(chǎn)物為模板進行PCR擴增,獲得目標基因特定區(qū)域多樣化的突變序列集合;將所得序列集合與載體重組連接形成重組質(zhì)粒,得到基因突變文庫。

泓迅科技以其先進的設(shè)計與制造為基礎(chǔ),致力于構(gòu)建創(chuàng)新型合成生物學(xué)賦能技術(shù)平臺。我們在基因合成、引物/探針合成、RNA合成、文庫合成、重組抗體及蛋白表達、Sanger/二代測序、基因編輯等領(lǐng)域不斷探索,將創(chuàng)新融入每一個環(huán)節(jié),為客戶提供高效、可靠的解決方案。
我們的團隊擁有深厚的行業(yè)經(jīng)驗和跨學(xué)科背景,秉承著設(shè)計、構(gòu)建、測試、學(xué)習(xí)(DBTL)的循環(huán)迭代原則,憑借獨特的視角和前瞻性的思維,敢于挑戰(zhàn)生物科技邊界。
自成立以來,泓迅科技總計合成100億堿基、100萬修飾引物、100萬基因。未來,我們還要合成更多產(chǎn)物。在無限合成的世界里,泓迅科技以創(chuàng)新為信仰,不斷推動生物科技的進步,為構(gòu)建未來的科技生態(tài)系統(tǒng)貢獻力量。在這場掌握創(chuàng)新為主旋律的合成交響曲中,我們是開拓者,是引領(lǐng)者,是無限合成的創(chuàng)新者。無限合成,盡在掌握!
參考文獻
[1] Wang J, Nielsen J, Liu Z. Synthetic Biology Advanced Natural Product Discovery. Metabolites. 2021 Nov 17;11(11):785.
| 免責聲明:本文轉(zhuǎn)載上述內(nèi)容出于傳遞更多信息之目的,不代表本網(wǎng)的觀點和立場,故本網(wǎng)對其真實性不負責,也不構(gòu)成任何其他建議;本網(wǎng)站圖片,文字之類版權(quán)申明,因為網(wǎng)站可以由注冊用戶自行上傳圖片或文字,本網(wǎng)站無法鑒別所上傳圖片或文字的知識版權(quán),如果侵犯,請及時通知我們,本網(wǎng)站將在第一時間及時刪除。 |